
CDE发布丨国家药监局药审中心关于发布《抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则》的通告(2024年第42号)
编辑:2024-11-07 16:32:38

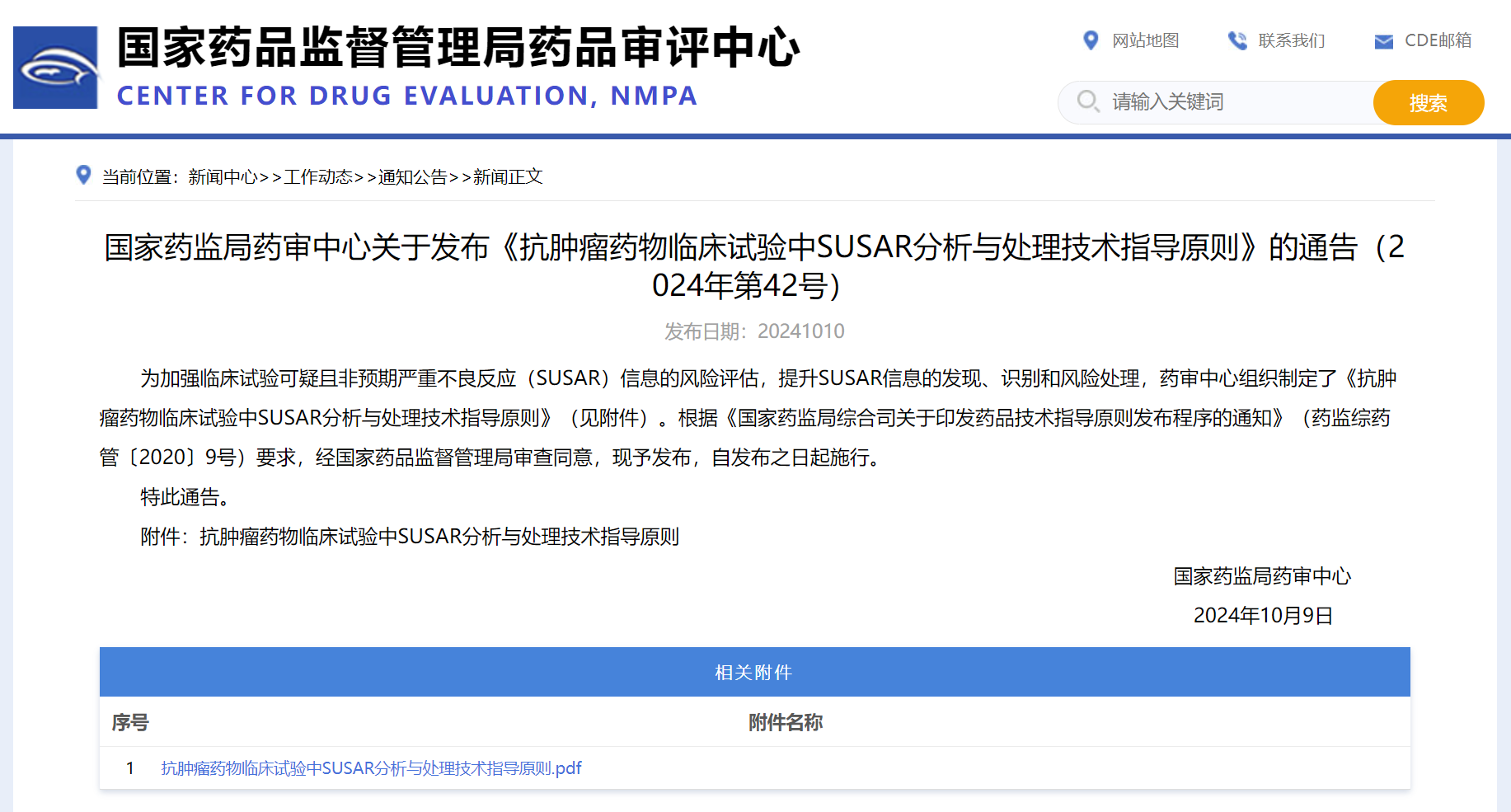
国家药监局药审中心关于发布《抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则》的通告(2024年第42号)
发布日期:20241010
为加强临床试验可疑且非预期严重不良反应(SUSAR)信息的风险评估,提升SUSAR信息的发现、识别和风险处理,药审中心组织制定了《抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则
国家药监局药审中心
2024年10月9日
附件:


















版权所有 Copyright(C)2022 中仁康博(北京)医药科技有限公司 京ICP备2023008776号 互联网药品信息服务资格证书编号:(京)-非经营性-2023-0009






